小肠平滑肌细胞细胞现价
大鼠结肠黏膜上皮细胞分离自结肠组织;结肠在右髂窝内续于盲肠,在第3骶椎平面连接直肠。结肠分升结肠、横结肠、降结肠和乙状结肠4部,大部分固定于腹后壁,结肠的排列酷似英文字母“M”,将小肠包围在内。分离的细胞在培养12-18小时开始贴壁,呈岛状方式生长,18-24小时开始大量贴壁并开始生长,24小时后细胞逐步汇合,细胞平展呈铺路鹅卵石妆镶嵌排列。结肠黏膜上皮细胞主要功能:结肠黏膜上皮细胞分泌大肠液,润滑肠管及粪便和促使粪便成型并易于粪便向直肠运动。人牙龈上皮细胞分离自牙龈;牙龈表面为复层鳞状上皮,有角化层或不全角化层。小肠平滑肌细胞细胞现价

过继性细胞免疫如嵌合抗原受体T细胞(CAR-T)等被成功应用于急性B淋巴白血病等血液类,引起了研究人员对CAR-T疗法用于实体的巨大兴趣。研究表明,尽管CAR-T疗法对实体有效,但实体中复杂的免疫抑制微环境(TME),包括抑制性细胞和抑制性细胞因子,导致CAR-T疗效不佳。如何克服TME成为实体瘤过继细胞成功的一个巨大障碍。近日,研究人员报道利用骨髓间充质干细胞(BMSC)系统性递送工程腺病毒(OAd),通过肿瘤细胞产生溶瘤作用进而破坏TME,有望增强CAR-T细胞疗效。研究人员使用BMSCs系统性地递送含有OAd的二元载体(CAd-MSCs)以及白细胞介素-12(IL-12)和程序性死亡配体1(PD-L1)阻滞剂。骨髓间充质干细胞载体释放并产生功能毒和裂解肺肿瘤细胞,同时通过释放IL-12和PD-L1阻断剂,刺激CAR-T细胞抗活性。体外实验结果证实,HER-2特异性CAR-T细胞可有效消除3D球体,并在体内两种原位肺模型中抑制生长。与使用CAR-T细胞相比,使用CAd-MSCs可增加体内人类T细胞的总数,并增强其多功能细胞因子的分泌。 小肠平滑肌细胞细胞费用大鼠心脏纤维原细胞分离自心肌。
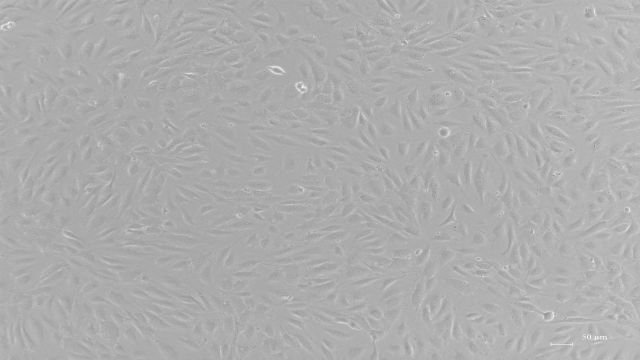
大鼠肺巨噬细胞分离自肺泡组织;肺巨噬细胞来源于骨髓生成的单核细胞向肺内的迁移,无论在生理状态或炎症时,这都是肺内口噬细胞的主要来源。生理情况下,单核细胞向肺内迁移时,首先停留附着于肺血管内壁,再逐步迁移进入肺间质、肺泡腔及小气道,也有部分进入胸膜腔。巨噬细胞功能及其在疾病发生过程中的作用是目前研究的热点问题之一。肺巨噬细胞的吞噬、免疫和分泌作用都十分活跃,有重要防御功能。肺泡是重要的巨噬细胞储存organ , 为结核病的研究提供了重要的材料。
近日,延世大学医学院的研究人员从临床级人胚胎干细胞(hESC)中大规模生成高纯度的中脑多巴胺能(mDA)祖细胞,并在体外和体内验证了mDA祖细胞的安全性和有效性。mDA祖细胞以移植剂量依赖性地改善了帕金森病大鼠模型的疾病相关行为。基于这些这些临床前研究结果,研究团队获得了韩国食品和药物批准进行帕金森病细胞疗法的1/2a期临床试验,并开始了对12名帕金森病患者的。麻省总医院的研究人员在《新英格兰医学杂志》(NEJM)报告了一项开创性研究,一名接受自体移植hiPSC来源的mDA祖细胞的帕金森病患者,在植入后24个月时表现出临床症状稳定或改善。现在,这种方法得到了进一步的发展,hiPSC来源的hESC来源的mDA祖细胞开始进入到早期临床试验阶段。 大鼠子宫内膜上皮细胞分离自子宫。

自然杀伤细胞(NKCells)通过释放穿孔素和颗粒酶等细胞毒性物质以及诱导细胞凋亡等途径发挥抗和变细胞的功能,是维持机体免疫稳态的重要成员。外泌体(Exo)是介导细胞间通讯的重要介质,通过递送生物活性分子如脂质、蛋白质和核酸从而调控靶细胞的功能。研究证实,来源于NK细胞的Exo继承了其部分生物学特性,基于其高生物亲和性、受免疫微环境影响小、安全性高以及易于进行工程化改造等优势,被认为是一种新型的抗的无细胞疗法,具有巨大的临床转化潜力。近日,研究人员展示了一种负载顺铂的NK细胞来源工程化外泌体(eNK-EXO),发挥更强的抗卵巢功效。研究人员在体外实验中发现eNK-EXO表达NK细胞特征蛋白和细胞毒性物质,并可被卵巢细胞选择性摄取,直接诱导卵巢细胞凋亡。基于上述特性,研究人员尝试利用eNK-EXO作为药物递送系统负载顺铂,以进一步提升抗效果。实验表明,负载顺铂的eNK-EXO抑制卵巢细胞生长,特别是对化疗药物抵抗的细胞的增殖受到抑制。同时研究人员还发现eNK-EXO可以增强在微环境能受损的NK细胞的细胞毒性作用,进而增强抗卵巢细胞的杀伤效果。综上,该研究结果展示了eNK-EXO通过自身发挥直接杀伤细胞作用,兼药物递送系统负载顺铂的双重抗功效。 菩禾生产的人角膜上皮细胞采用胰蛋白酶和胶原酶混合消化制备而来。肺泡上皮细胞细胞特价
气管的粘膜表面为假复层纤毛柱状上皮。小肠平滑肌细胞细胞现价
抗原嵌合受体(CAR)T细胞疗法是放化疗、手术症的又一有力策略,已在血液系统恶性的临床中取得瞩目的成果。CAR-T细胞疗法采集患者的T细胞并于体外进行生物工程改造,使其识别细胞表面抗原,随后将改造后的CAR-T细胞回输到患者体内,达到识别和的杀死细胞的效果。然而在过程中,CAR-T细胞会随时间推移逐渐失去效果,即T细胞耗竭现象,是目前CAR-T面临的一大主要挑战。短期有效的CAR-T细胞疗法也意味着患者存在症复发的风险,可能是CAR-T实体效果不理想的解释之一。近日,研究人员报道敲除SUV39H1基因,可以有效增强CAR-T细胞功能,促进CAR-T细胞扩增,防止T细胞耗竭的出现,从而发挥长效抗能力,预防复发。研究证实,T细胞耗竭与细胞表观遗传学有密切关系。SUV39H1是一种H3K9甲基转移酶,介导H3K9甲基化,从而抑制多个基因的表达。研究人员使用CRISPR-Cas9基因编辑技术敲除了人类CAR-T细胞中的SUV39H1基因(SUV39H1KO),随后他们将SUV39H1KOCAR-T细胞移植到人白血病细胞或前列腺小鼠体内。结果显示,SUV39H1KOCAR-T细胞维持功能,未发生耗竭,小鼠存活,而采用传统CAR-T细胞的小鼠死亡。此外,研究人员还表示新的CAR-T细胞疗法需要的细胞数量更少。 小肠平滑肌细胞细胞现价
上一篇: 真皮成纤维细胞细胞费用
下一篇: 骨骼肌细胞细胞特价