厦门细胞生物学膜片钳原理及步骤
膜片钳操作实验:标本制备根据研究目的的不同,可采用不同的细胞组织,如心肌细胞、平滑肌细胞、细胞等,现在几乎可对各种细胞进行膜片钳的研究。对所采用的细胞,必须满足实验要求,一般多采用酶解分离法,也可采用细胞培养法;另外,由于与分子生物学技术的结合,现在也运用分子克隆技术表达不同的离子通道,如利用非洲爪蟾卵母细胞表达外源性基因等。电极在实验前要灌注电极液,由于电极较细,因此在充灌前,电极内液要用0.2 μm的滤膜进行过滤。一般电极充灌可分灌尖(tipfilling)和后充两步灌尖时将电极浸入内液中5s即可。膜片钳技术是用于纪录全细胞或个别细胞膜上离子信道电生理特性的研究方法。厦门细胞生物学膜片钳原理及步骤
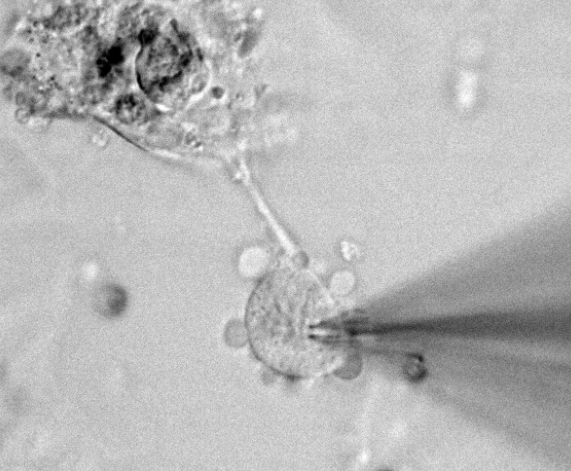
膜片钳技术的基本原理和方法:膜片钳使用的基本方法是,把经过加热抛光的玻璃微电极在液压推进器的操纵下,与清洁处理过的细胞膜形成高阻抗封接,导致电极内膜片与电极外的膜在电学上和化学上隔离起来,由于电性能隔离与微电极的相对低电阻(1~5MΩ),只要对微电极施以电压就能对膜片进行钳制,从微电极引出的微小离子电流通过高分辨、低噪声、高保真的电流-电压转换放大器输送至电子计算机进行分析处理。膜片钳技术实现的关键是建立高阻抗封接,并能通过特定的记录 仪器 反映这些变化。厦门细胞生物学膜片钳原理及步骤膜片钳系统有如下应用局限性:胞体表面不规整,现有的自动膜片钳系统难以派上用场。
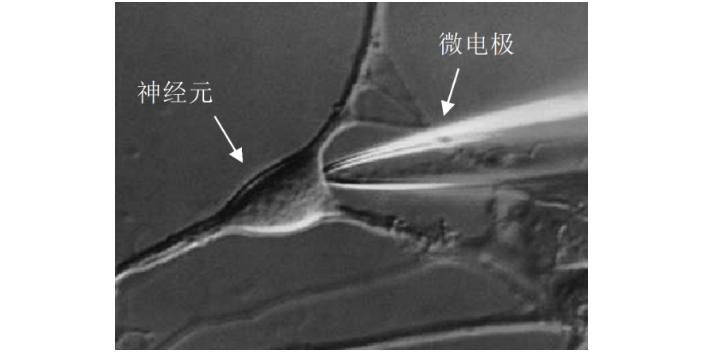
膜片钳技术基本原理与特点:膜片钳的基本原理则是利用负反馈电子线路,将微电极所吸附的一个至几个平方微米的细胞膜的电位固定在一定水平上,对通过通道的微小离子电流作动态或静态观察,从而研究其功能。膜片钳技术实现膜电流固定的关键步骤是在玻璃微电极边缘与细胞膜之间形成高阻密封,其阻抗数值可达10~100 GΩ(此密封电阻是指微电极内与细胞外液之间的电阻)。由于此阻值如此之高,故基本上可看成绝缘,其上之电流可看成零,形成高阻密封的力主要有氢健、范德华力、盐键等。此密封不光电学上近乎绝缘,在机械上也是较牢固的。
膜片钳电生理纪录系统及记录方法:膜片钳技术是用于纪录全细胞或个别细胞膜上离子信道电生理特性的研究方法,目的在于提供基础研究知识与新药开发时研究细胞电特性或小分子药物对细胞膜上离子信道特性的影响,替开发标靶药物提供一个测试平台。传统的细胞培养膜片钳系统由人工操作,实验人员在取得元代细胞(例如心肌细胞与神经元)后,将研究对象细胞养在玻片上,以手动方式将纪录电极移动放置在胞体上方并压到细胞膜上,此时纪录电极在膜外溶液里的电阻大约为3-9 ΜΩ。记录单细胞电流和全细胞电流的基础上进一步计算出细胞膜上的通道数和开放概率。

膜片钳操作实验:膜片钳放大器是整个实验系统中的中心,它可用来作单通道或全细胞记录,其工作模式可以是电压钳,也可以是电流钳。从原理来说,膜片钳放大器的探头电路即I-V变换器有两种基本结构形式,即电阻反馈式和电容反馈式,前者是一种典型的结构,后者因用反馈电容取代了反馈电阻,降低了噪声,所以特别适合很低噪声的单通道记录。由于供膜片钳实验的专门计算机硬件及相应的软件程序的相继出现,使得膜片钳实验操作简便、效率提高。如与EPC-9型膜片钳放大器(内含ITC-16数据采集/接口卡)配套使用的软件PULSE/PULSEFIT,它既可产生刺激波形,控制数据采集,又可分析数据,同时具有用于膜电容监测的锁相放大器,多种软件功能集成于一体。膜片钳系统有如下应用局限性:大部分的纪录对象为化细胞,而对于需要贴壁生长的大多数正常细胞。厦门细胞生物学膜片钳原理及步骤
目前电压钳主要用于巨大细胞的全性能电流的研究。厦门细胞生物学膜片钳原理及步骤
膜片钳电生理技术:神经元细胞膜上有离子通道,它们控制电荷流入和流出细胞,从而调节神经元激发。一种用于研究这些通道的生物物理学特性的极为有用的技术被称为膜片钳记录。在这种方法中,神经科学家把抛光的玻璃微吸管置于细胞上通过吸力形成高电阻封接。这个过程分隔了一小"片"包含一种或多种离子通道的膜。通过微吸管中的电极,研究人员可以"钳制"或控制膜的电属性,这对分析通道活动很重要。该电极还能记录跨膜电压的变化,或离子通过膜的流动。厦门细胞生物学膜片钳原理及步骤
上一篇: 杭州细胞PCR检测技术服务
下一篇: 莆田特殊样本RT-PCR检测技术网站