北京病理切片免疫组化分析
免疫组化实验中,优化抗原修复选择策略简述:首先,依据抗原理化性质和位置(细胞质、膜、核)选择修复方法。其次,初步试验确定是否需修复。细胞质抗原倾向温和修复;细胞膜抗原可能需较强修复;细胞核抗原则需准确修复。特殊抗原依据文献指导。优化修复条件,调整pH、温度、时间。设置对照,包括阴性、阳性及修复条件对照,确保结果准确性。进行预实验,对比不同修复条件下染色效果。考虑组织和固定因素对修复方法的影响。综上,合理选择修复方法需准确考虑抗原特性、实验条件,通过系统性测试优化。特异性抗体的选择是决定免疫组化实验成功与否的重要因素之一。北京病理切片免疫组化分析
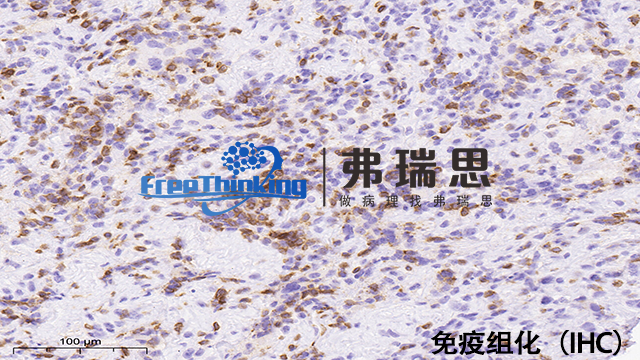
确定免疫组化实验的抗体浓度对确保特异性和敏感性极为关键。此过程涉及多步策略:1、文献参考与厂家指南:查阅相关研究文献获取抗体浓度信息,并仔细阅读生产商建议的起始浓度范围。2、预实验滴定:通过一系列稀释度测试(如1:100至1:1000)进行预实验,每浓度设多个重复,以评估适合浓度。3、特异性和敏感性评估:观察染色强度与背景,理想浓度下目标抗原染色清晰,背景低,确保高特异性和敏感性。4、孵育条件优化:调整一抗(37°C, 1-2小时或4°C过夜)和二抗(室温或37°C, 30分钟-1小时)的孵育时长和温度,以效果好染色为目标。5、使用对照:设立阳性及阴性对照验证抗体特异性,阳性对照为已知目标蛋白阳性样本,阴性对照则无目标蛋白或使用非免疫血清。6、重复验证:确定初定浓度后重复实验,确保结果一致性。7、详实记录与持续优化:记录每次实验参数及结果,必要时微调,直至达到既敏感又特异的理想浓度。盐城病理切片免疫组化扫描免疫组化的价格是多少?
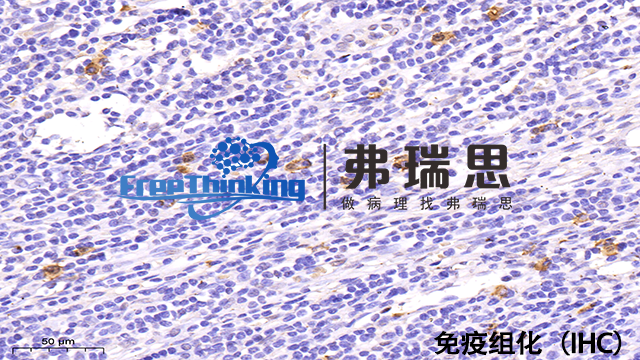
优化多重免疫组化背景高问题策略有以下几点:1、优化封闭,使用血清或BSA预处理减少非特异结合。2、调整抗体浓度,通过滴定找浓度。3、缩短孵育时长和调低温度。4、改善洗涤流程,加强去除未结合抗体。5、选择高特异抗体,减少交叉反应。6、调整抗原修复条件,平衡暴露抗原与背景控制。7、选光谱分离好的荧光染料,用光谱成像减少串色。8、采用TSA等信号放大技术,增强特异信号。9、控制实验条件一致性。10、实施阴性对照,确保结果特异性。
保存和运输免疫组化样本的关键点:1、快速固定(<20分钟)于适量(样本体积20倍)固定液中。2、使用适宜固定剂(如10%中性福尔马林),掌握合适固定时间(6-24小时)。3、固定后室温稳定至少两天,冰冻样本-80℃保存,运输时用干冰或冰袋维持低温。4、完整标注样本信息,确保记录无误。5、选平底容器防损。6、定期更换固定液。7、运输时密封防污染损坏。8、石蜡包埋前完成脱水、透明步骤。9、建议备份样本。10、遵守相关法规和生物安全标准。合理措施确保样本质量与实验准确性。如何提高免疫组化染色结果的特异性?
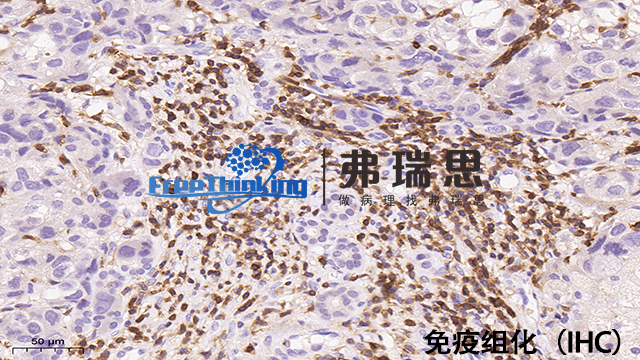
在免疫组化实验中,选择合适的抗体并优化其浓度是确保实验成功的关键步骤。以下是一些建议:1、选择合适的抗体:根据实验目的和需要检测的抗原特性,选择特异性高、交叉反应少的抗体。注意抗体的种属来源,避免与样本中的内源性免疫球蛋白产生交叉反应。考虑抗体的单克隆或多克隆性质,单克隆抗体通常具有更高的特异性,而多克隆抗体可能具有更高的灵敏度。2、优化抗体浓度:一般来说,初级抗体的推荐使用浓度范围在1:500到1:5000之间,但具体浓度需根据实验条件和目标抗原的表达水平进行调整。从制造商推荐的浓度范围内选择几个不同的浓度进行预实验,观察信号的强度和背景情况。逐步调整抗体浓度,直到获得合适信号与背景比例。可以先从较高浓度开始,然后逐渐降低,直至找到合适浓度。3、注意事项:仔细阅读抗体说明书,了解抗体的适用范围、种属反应性和保存条件等信息。使用新鲜制备的抗体溶液,避免使用过期或变质的抗体。优化其他实验条件,如抗原修复方法、封闭条件、孵育时间和温度等,以提高实验的准确性和可靠性。免疫组化技术,以特异性抗体为探针,有效识别细胞内目标蛋白。揭阳病理切片免疫组化分析
为减少背景干扰,选用合适的修复液,封闭液,单克隆一抗等对提高免疫组化结果质量至关重要。北京病理切片免疫组化分析
免疫组化实验设计中,对照组选择对确保结果特异性和有效性至关重要。关键对照类型包括:1、空白对照:用PBS替代一抗,检验二抗非特异性结合及背景染色。2、阴性组织对照:选不表达目标抗原组织,确认抗体特异性,防假阳性。3、阳性组织对照:用已知阳性样本验证实验敏感性及染色条件。4、同型对照:用非目标抗原的相同物种抗体,检测二抗非特异性。5、阻断与预吸附对照:预饱和一抗以验证染色特异性。6、序列特异性抗体对照:多克隆抗体实验中,用单克隆抗体增强特异性验证。7、实验条件对照:调整修复条件等,优化实验参数。北京病理切片免疫组化分析
上一篇: 苏州切片病理染色
下一篇: 泰州组织芯片病理图像扫描