CY3免疫荧光检查
免疫荧光-实验步骤:细胞爬片免疫荧光:在培养板中将已爬好细胞的玻片用PBS浸洗3次,每次5min;(圆盖片:13mm24孔;18mm12孔;20mm6孔)用4%的多聚甲醛固定爬片15min,PBS浸洗玻片3次,每次5min0.5%TritonX-100(PBS配制)室温通透20min(细胞膜上表达的抗原省略此步骤);PBS浸洗玻片3次,每次3min,吸水纸吸干PBS,在玻片上滴加3%的BSA(PBS配置),室温封闭30min5,吸水纸吸掉封闭液,不洗,每张玻片滴加足够量用PBS稀释好的一抗并放入湿盒,4℃孵育过夜。加荧光二抗:PBS浸洗爬片3次,每次5min,吸水纸吸干爬片上多余液体后滴加稀释好的荧光二抗,湿盒中室温孵育50min。免疫荧光技术可以同时检测多个目标分子,通过不同颜色的荧光染料进行标记。CY3免疫荧光检查
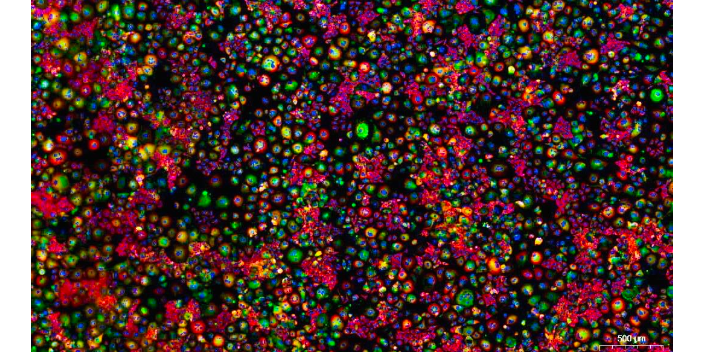
细胞免疫荧光实验注意事项:根据所检测抗原所在位置来确认是否需要加入 Triton 进行通透。若所检测抗原表位位于膜蛋白的白外段,则不需要通透;一般 5% BSA 封闭即可达到效果;从加荧光二抗起,后面所有操作步骤尽量避光。缩短在荧光显微镜下的观察时间,1~2 h 为宜。染色后尽快荧光显微镜下观察,若不能可放入 4 ℃ 冰箱避光保存一周。无/弱染色:烤片温度过高,推荐 56~60 ℃ 1~2 h;一抗是否适用固定液和石蜡切片,使用浓度是否过低,孵育是否时间过短等。CK14免疫免疫荧光技术可以用于研究细胞凋亡和细胞存活。
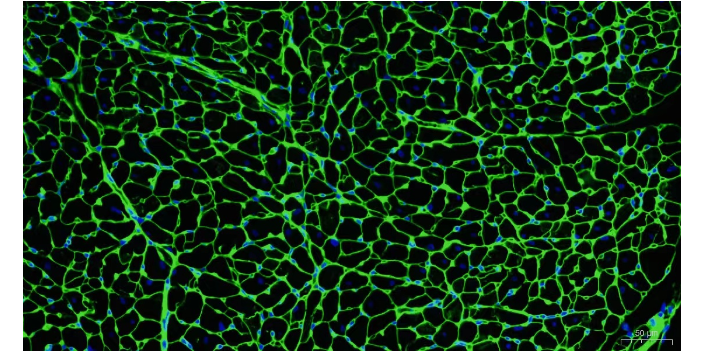
荧光标记二抗的选择普遍;与使用荧光素结合一抗的检测相比,成本较低。间接免疫荧光的缺点:由于需要具有两种不同物种反应性的两种抗体,因此物种交叉反应性问题增加;与直接免疫荧光相比,时间更长(操作步骤更多)。间接免疫荧光的优点:通过增加能够与一抗结合的二抗数量进行信号放大;与直接免疫荧光相比,通过信号放大提高检测灵敏度;荧光标记二抗的选择普遍;与使用荧光素结合一抗的检测相比,成本较低。间接免疫荧光的缺点:由于需要具有两种不同物种反应性的两种抗体,因此物种交叉反应性问题增加;与直接免疫荧光相比,时间更长(操作步骤更多)。
细胞免疫荧光实验注意事项:非特异性染色:是否灭活内源性过氧化物酶;孵育过程中干片;抗原热修复过度。染色过深:一抗浓度过高;染色试浓度过高或孵育时间过长;染色剂浓度过高或孵育时间过长。通常实验室先固定细胞再进行通透,但若检测抗原是水不溶性蛋白,可先通透再固定,这样可以通过通透去除一些水溶性蛋白,进而可降低免疫荧光背景和非特异性信号;建议设阴性对照组,消除由于抗体非特异性结合而产生的背景染色;选择醛类固定液时,保持其新鲜度,较好现配现用,使用不新鲜的醛类固定液自发荧光背景会升高。免疫荧光技术可以用于研究细胞迁移和细胞黏附。
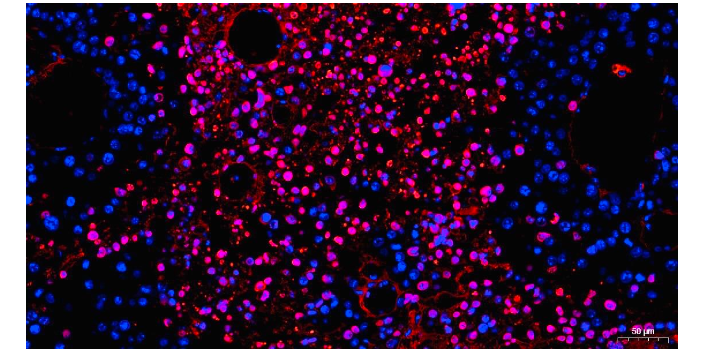
直接免疫荧光:单抗体(一抗)用于免疫染色和检测目标蛋白。荧光素结合的一抗直接与目标抗原结合,并使用成像显微镜观察。直接免疫荧光的优点:由于无需为两种抗体选择不同的物种反应性,从而降低了物种交叉反应性问题。与间接免疫荧光相比,时间缩短(操作步骤减少)。直接免疫荧光的缺点:不允许通过二抗进行信号放大;检测灵敏度降低;荧光素结合一抗的选择有限;与使用荧光二抗的检测相比,更昂贵。间接免疫荧光:使用两种抗体(一抗和二抗)进行免疫染色并检测目标蛋白。首先,用特异性一抗标记目标蛋白。然后,荧光素结合的二抗(与一抗具有不同的物种反应性)识别结合的抗原-抗体复合物并与一抗结合。由于一个以上的二抗可以与一抗结合,荧光信号被放大,提供了更高的检测灵敏度。免疫荧光技术可以用于研究细胞内蛋白质的亚细胞定位。CD34免疫荧光检查
免疫荧光技术在生物医学研究中具有普遍的应用前景。CY3免疫荧光检查
细胞免疫荧光:细胞种板与细胞爬片制备:1) 细胞密度在90%-95%左右,用预热胰酶消化细胞后重悬细胞于完全培养基中,充分吹打,使之成单细胞悬液,计数。2)取细胞培养12孔板,在每个孔放爬片的位置根据爬片的大小,先在每个孔里准备放爬片的位置滴几滴培养基,然后将爬片置于液滴上,压紧,使爬片与培养皿靠培养基的张力粘合到一起,防止加细胞悬液时爬片漂起,造成双层细胞贴片。根据自己的需要选择合适的细胞密度种入12孔板培养板内。3)24h或者48h后,根据细胞生长速度快慢,观察判断细胞密度,约90%时进行细胞免疫荧光。CY3免疫荧光检查
上一篇: 杭州阿利新蓝扫描仪成像
下一篇: 上海WGA扫描成像工具