有源医疗器械设计
设计方案的制定:R&D部门根据批准的设计开发任务书制定设计开发计划。它包括内容设计和开发的所有阶段(计划阶段、输入阶段、输出阶段、审查阶段、试验阶段、试验阶段、定稿阶段等。),适用于各阶段的设计评审、验证和确认活动,各阶段的任务、责任人、进度要求以及需要增加和调整的资源。设计方案经R&D部门审核后,提交总经理审批。设计输入的评审:设计输入完成后,R&D部组织相关部门和人员对设计输入进行评审。评审内容包括设计和开发任务书规定内容的完整性和合理性,产品的预期用途、功能和结构,满足顾客要求的程度,国家法律法规的要求以及设计和开发计划所包含内容和资源的调整。R&D部根据评审情况编写设计输入评审报告,包括需要采取的措施。R&D部门负责人审核后,该报告将提交给总经理审批,R&D部门将跟踪需要采取的措施。越来越多的医疗器械企业开始选择第三方技术服务商进行产品设计开发服务。有源医疗器械设计

医疗器械设计开发的文档管理非常重要。服务商需要对设计开发过程中产生的各种文档进行规范化管理,包括需求规格书、设计文档、测试文档、质量控制文档等。同时,服务商还需要确保文档的准确性和完整性,以保证产品的质量和合规性。目前越来越多的企业选择了设计开发的外包服务,医疗器械设计开发外包服务的优势包括降低成本、提高效率和增强创新能力。外包服务商可以提供专业的医疗器械设计开发服务,具备丰富的经验和专业的技能,能够快速、高效地完成客户的项目。同时,外包服务商还能提供创新性的解决方案,帮助客户开发出具有市场竞争力的产品。医疗器械研发需要什么专业合理的材料选择不仅可以提高医疗器械的安全性和有效性,同时也能降低成本。
设计方案的制定:R&D部根据批准的设计开发任务书制定设计开发计划。它包括内容设计和开发的所有阶段(计划阶段、输入阶段、输出阶段、审查阶段、试验阶段、试验阶段、定稿阶段等),适用于各阶段的设计评审、验证和确认活动,各阶段的任务、责任人、进度要求以及需要增加和调整的资源。设计方案经R&D部门审核后,提交总经理审批。设计输入的评审:设计输入完成后,R&D部组织相关部门和人员对设计输入进行评审。评审内容包括设计和开发任务书规定内容的完整性和合理性,产品的预期用途、功能和结构,满足顾客要求的程度,国家法律法规的要求以及设计和开发计划所包含内容和资源的调整。R&D部根据评审情况编写设计输入评审报告,包括需要采取的措施。R&D部门负责人审核后,将该报告提交给总经理审批,R&D部门将跟踪需要采取的措施。
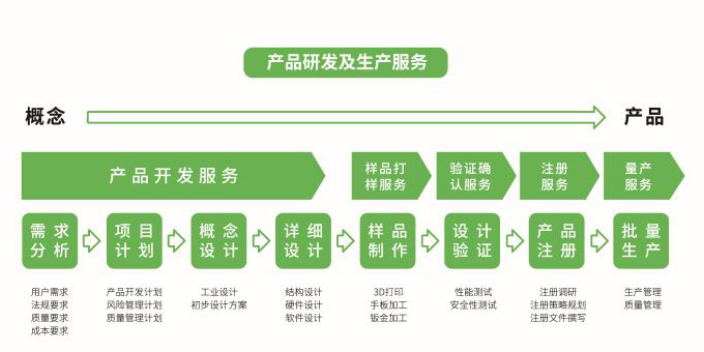
一般来说,创始人根据科研成果和产品布局成立公司,并初步建立了研发团队,具备了合作伙伴。但对于初创企业来说,由于大量的资金注入和技术突破难题,产品设计开发阶段难度很大,研发时间也难以预测,从几个月到几年不等。那么,如何在产品设计开发阶段降低成本的基础上,同时满足需求、增加创新呢?首先,在产品技术层面,专业高效的研发团队是前提和基础;其次,在监管层面,建议找专业的研发服务公司或引入监管团队,对产品研发进行严格的风险评估,明确产品申报类型。思脉得医疗科技集团秉承创新技术和服务,为客户提供超预期价值为宗旨,致力于为医疗行业客户提供全套技术解决方案,为不同客户提供定制型的设计开发服务,具体涵盖产品需求分析、项目计划、概念设计、详细设计、样品制作、设计验证、产品注册等。设计开发转化,需要确保每个规范都能正确转化为与产品实现相关的具体过程或程序。
医疗器械设计开发服务中的产品试验是验证产品性能和质量的重要环节。产品试验需要严格按照相关法规和标准进行,包括性能测试、安全测试、稳定性测试等多方面试验,确保产品能够顺利通过审批和上市。段落四十四:医疗器械设计开发服务中的生产制造医疗器械设计开发服务中的生产制造是将设计方案转化为实际产品的关键环节。生产制造需要考虑产品的制造工艺、工装设计、工序控制等多方面因素,确保产品的生产效率和质量。段落四十五:医疗器械设计开发服务中的质量控制医疗器械设计开发服务中的质量控制是保证产品符合质量要求的重要保障。质量控制需要从产品设计、生产制造到产品试验和上市等全过程进行质量控制。市场研究是医疗器械设计开发的重要组成部分之一,需要了解市场趋势和竞争情况。南京医疗器械设计开发有哪些
持续的用户研究和用户体验测试是医疗器械设计开发过程中必不可少的一环。有源医疗器械设计
医疗器械设计开发涉及到许多方面的知识和技术,例如工程设计、生产制造、市场营销等等。其中重要的一点就是产品的安全性和质量可靠性。在设计开发过程中,需要进行各种测试和评估,以确保产品的合规性。这些测试包括生物相容性测试、功能性测试、性能测试等等。思脉得作为一家专业的医疗器械设计开发服务商,具有丰富的测试和评估经验,可以帮助客户确保产品符合标准和规定。医疗器械设计开发需要严格遵守行业标准和法规要求,因为医疗器械的安全性和质量直接关系到人们的生命健康。这些标准和法规包括ISO13485、FDA等国际标准和各国颁布的医疗器械管理规定。思脉得在设计开发过程中,始终保持对标准和法规的关注和遵守,以确保客户的产品符合各项要求。有源医疗器械设计
思脉得(嘉兴)医疗科技有限公司是一家集研发、制造、销售为一体的****,公司位于浙江省嘉兴市嘉善县罗星街道世纪大道3088号3号楼3402室(住所申报),成立于2020-04-02。公司秉承着技术研发、客户优先的原则,为国内技术服务,注册服务,产品服务,制造服务的产品发展添砖加瓦。在孜孜不倦的奋斗下,公司产品业务越来越广。目前主要经营有技术服务,注册服务,产品服务,制造服务等产品,并多次以商务服务行业标准、客户需求定制多款多元化的产品。思脉得(嘉兴)医疗科技有限公司每年将部分收入投入到技术服务,注册服务,产品服务,制造服务产品开发工作中,也为公司的技术创新和人材培养起到了很好的推动作用。公司在长期的生产运营中形成了一套完善的科技激励政策,以激励在技术研发、产品改进等。思脉得(嘉兴)医疗科技有限公司严格规范技术服务,注册服务,产品服务,制造服务产品管理流程,确保公司产品质量的可控可靠。公司拥有销售/售后服务团队,分工明细,服务贴心,为广大用户提供满意的服务。
上一篇: 南京医疗器械设计开发费用
下一篇: 深圳医疗器械设计开发开发内容