细胞免疫检测
直接免疫荧光:单抗体(一抗)用于免疫染色和检测目标蛋白。荧光素结合的一抗直接与目标抗原结合,并使用成像显微镜观察。直接免疫荧光的优点:由于无需为两种抗体选择不同的物种反应性,从而降低了物种交叉反应性问题。与间接免疫荧光相比,时间缩短(操作步骤减少)。直接免疫荧光的缺点:不允许通过二抗进行信号放大;检测灵敏度降低;荧光素结合一抗的选择有限;与使用荧光二抗的检测相比,更昂贵。间接免疫荧光:使用两种抗体(一抗和二抗)进行免疫染色并检测目标蛋白。首先,用特异性一抗标记目标蛋白。然后,荧光素结合的二抗(与一抗具有不同的物种反应性)识别结合的抗原-抗体复合物并与一抗结合。由于一个以上的二抗可以与一抗结合,荧光信号被放大,提供了更高的检测灵敏度。早期的免疫荧光技术是将抗体与示踪物质结合,用于定位组织或细胞内的抗原物质。细胞免疫检测
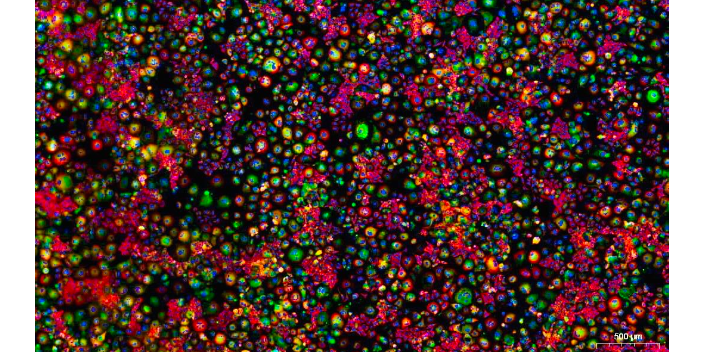
细胞的固定及免疫荧光:吸去一抗,使用PBS浸洗 3 次,每次 5 min。向孔内滴加足够量适宜浓度的二抗,37℃,室温避光孵育1小时。注意二抗带有荧光素标记,因此操作过程尽量在暗处进行。吸去二抗,使用PBS浸洗 3 次,每次 5 min。向玻片上滴加DAPI,或者Hoechst复染细胞核,一般为蓝色荧光;避光孵育5-10min。使用PBS轻洗细胞3 次,每次 5 min,洗去多余的DAPI。取爬片时由于爬片与培养皿底结合较紧,张力较大,可将注射器针头针尖向背面做个小钩,这样将爬片轻轻勾起,用小镊子取出即可。用吸水纸吸干爬片上的液体,用含抗荧光淬灭剂的封片液封片,注意将爬片反过来贴于多聚赖氨酸载玻片上,然后在荧光显微镜下观察并采集图像,注意选择抗体对应的激发光源。细胞免疫检测免疫荧光技术在免疫学研究中发挥重要作用,帮助揭示细胞和分子的功能和相互关系。
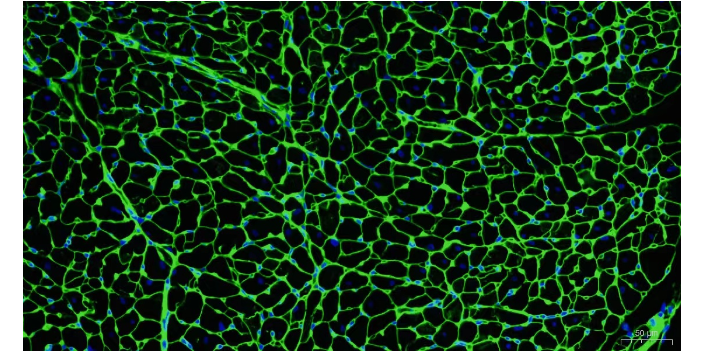
免疫荧光实验的注意事项:对荧光标记的抗体的稀释,要保证抗体的蛋白有一定的浓度,一般稀释度不应超过1:20,抗体浓度过低,会导致产生的荧光过弱,影响结果的观察。染色的温度和时间需要根据各种不同的标本及抗原而变化,染色时间可以从10min到数小时,一般30min已足够。染色温度多采用室温(25℃左右),高于37℃可加强染色效果,但对不耐热的抗原(如流行性乙型脑炎病毒)可采用0-2℃的低温,延长染色时间。低温染色过夜较37℃30min效果好的多。
免疫荧光-实验步骤:细胞爬片免疫荧光:在培养板中将已爬好细胞的玻片用PBS浸洗3次,每次5min;(圆盖片:13mm24孔;18mm12孔;20mm6孔)用4%的多聚甲醛固定爬片15min,PBS浸洗玻片3次,每次5min0.5%TritonX-100(PBS配制)室温通透20min(细胞膜上表达的抗原省略此步骤);PBS浸洗玻片3次,每次3min,吸水纸吸干PBS,在玻片上滴加3%的BSA(PBS配置),室温封闭30min5,吸水纸吸掉封闭液,不洗,每张玻片滴加足够量用PBS稀释好的一抗并放入湿盒,4℃孵育过夜。加荧光二抗:PBS浸洗爬片3次,每次5min,吸水纸吸干爬片上多余液体后滴加稀释好的荧光二抗,湿盒中室温孵育50min。免疫荧光技术具有高灵敏度和高特异性,可以检测非常低浓度的目标分子。
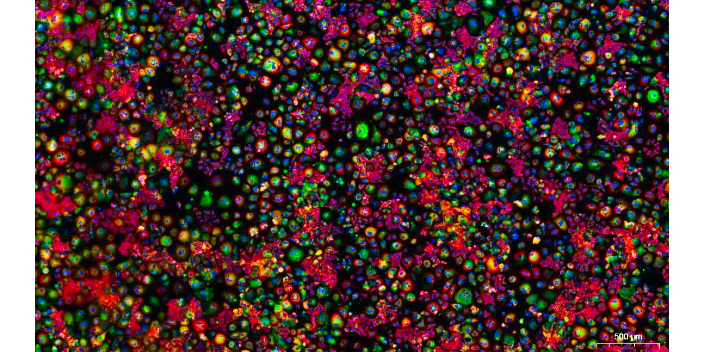
免疫荧光检测相对于酶检测的优势:定量荧光信号的能力(与使用基于酶的方法进行的定性测定相反);复用能力(可以结合不同发射光谱的荧光染料来检测多种蛋白质);荧光染料的光稳定性。免疫荧光技术是根据抗原抗体反应的原理,先将已知的抗原或抗体标记上荧光素,制成荧光抗体,再用这种荧光抗体(或抗原)作为探针检测组织或细胞内的相应抗原(或抗体)。在组织或细胞内形成的抗原抗体复合物上含有标记的荧光素,利用荧光显微镜观察标本,荧光素受外来激发光的照射而发生明亮的荧光(黄绿色或橘红色),可以看见荧光所在的组织细胞,从而确定抗原或抗体的性质、定位,以及利用定量技术测定含量。免疫荧光技术可以用于研究细胞信号传导和信号通路。HIF-1a免疫检测
使用已知荧光抗原标记物质来检查相应抗体的方法被称为荧光抗原技术。细胞免疫检测
免疫荧光固定(防止离体组织自溶抗原扩散),固定液包括:有机溶剂(甲醇、乙醇等);交联剂(4%PFA、10%中性福尔马林),固定液的选择取决于被研究抗原的性质及所用抗体的特性,不过,目前甲醛用的还是较多的,但针对磷酸化的抗体,不适合用甲醛,会导致磷酸蛋白从膜表面转移到胞浆中,故应选择冰冷的无水甲醇或无水乙醇,同时应注意甲醛会挥发,在4-8°C不宜储存太久。固定时间:取决于组合块的大小和类型,对于大多数组织,18-24h较为理想,细胞固定时间较短,一般2%的甲醛室温固定20min即可。以细胞样品为例:用4%的多聚甲醛固定爬片15min,PBS浸洗玻片3次,每次3min。细胞免疫检测