美国双光子显微镜的成像视野
光学显微镜和电子显微镜本质的区别在于,光学显微镜:用的是可见光电子显微镜:用的是高频电子射波有什么区别,在于一个基本的原理,光的衍射。。。光波是一个有趣的东西,其中有一项,如果物体的体积小于光的波长,光一般可以绕过去,不发生明显变化。也就是说,有这个物体和没这个物体,在这种情况下,光是不会发生明显改变的。可见光的波长(肉眼):380~780纳米,也就是,如果比380纳米还要小的东西,用光学显微镜,无论你放大多少倍,也是看不见的。因为光绕过去了。。。光的衍射为了克服这个问题,科学家用波长更短的光去照射物体,也是就被观测物。比如10纳米级的光,这样,就能看到我们用肉眼无论如何都看不见的东西。这就是电子显微镜多说一句,光速是不变的。光速=频率×波长。波长越短,频率越大。。频率越大,光波的能量越大。这就是为什么电子显微镜的功率越大,能看到的东西越小。颜色取决于物体能反射光的波长的长短当你看到的物体小于较小可见光的波长,那它就是没有颜色的。。。因为颜色是肉眼对于可见光频率在大脑中的投影。。。。所以只能把他们统一变为黑白。。。没有颜色不是透明的意思,它们不是肉眼可见颜色的定义中包含的。双光子显微镜的探测器,该怎么选用?美国双光子显微镜的成像视野
随着技术的发展,双光子显微镜的性能不断优化。结合其特点,大致可以分为两个方面:深入和主动改进。为了使激发激光进入更深的层次,可以从器件优化和标本改造两个方面入手。关于器件的优化,我们可以把激光束做得更细,集中能量,让激光穿透得更深。对于样品,物质的吸收和散射是影响光传播的主要因素。为了解决这个问题,我们需要将样本透明化。一种方法是用某种物质浸泡标本,使其中的物质(主要是脂质)被破坏或溶解。另一种方法是通过电泳电解脂类,从而提高标本的“透明度”。investigator双光子显微镜分辨率是多少双光子显微镜放大倍数是多少?

随着技术的发展,双光子显微镜的性能得到不断地优化,结合它的特点,大致可以分成深和活两个方面的提升。要想让激发激光进入更深的层面,大致可从两个方面入手,装置优化与标本改造。关于装置优化,我们可以把激光束变得更细,使能量更加集中,就能让激光穿透更深。关于标本,其中影响光传播的主要是物质吸收和散射,解决这个问题,我们需要对样本进行透明化处理。一种方法是运用某种物质将标本浸泡,使其中的物质(主要是脂质)被破坏或溶解。另一种方法是运用电泳将脂质电解,让标本的“透明度”提高。
通过对显微光学系统的重新设计,将FHIRM-TPM2.0的成像视场扩展至420×420平方微米,显微物镜的工作距离扩展至1mm,实现无创成像。嵌入可拆卸的快速轴向扫描模块,实现深度180微米的三维体成像和多平面快速切换的实时成像。该模块由一个快速电动变焦镜头和一对中继镜头组成,在不同深度成像时保持放大率恒定。其中,变焦模块重1.8克,科研人员可以根据实验要求自由拆卸。此外,新型微型成像探头可以瞬间插拔,极大简化了实验操作,避免了长时间实验对动物的干扰。反复装卸探针追踪同批神经元时,视场旋转角度小于0.07弧度,边界偏差小于35微米。优势来源于其双光子光源的非线性光学效应。
掺杂可以明显影响碳点(CDs)的发射和激发特性,使双光子碳点(TP-CDs)具有本征双光子激发特性和605nm的红光发射特性。在638nm激光照射下,除了长波激发和发射外,还可以实现活性氧(ROS)的产生,这为光动力技术提供了巨大的可能性。更重要的是,通过各种表征和理论模拟证实,掺杂诱导的N杂环在TP-CDs与RNA的亲和力中起关键作用。这种亲和力不仅为实现核仁特异性自我靶向提供了可能,而且通过ROS断裂RNA链解离TP-CDs@RNA复合物,赋予治疗过程中的荧光变异。TP-CDs结合了ROS的产生能力、光动力疗法(PDT)过程中的荧光变化、长波激发和发射特性以及核仁的特异性自靶向性,可以认为是一种结合核仁动态变化实时处理的智能CDs。双光子显微镜成像技术及不同转基因小鼠开展对多种脏器的成像研究。bruker双光子显微镜光子探测
双光子显微镜能够进行指标成像;美国双光子显微镜的成像视野
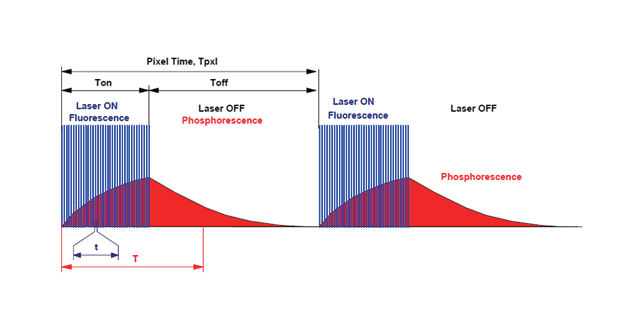
双光子显微镜是激光扫描共聚焦显微镜和双光子激发技术相结合的新技术。双光子激发的基本原理是:在光子密度较高的情况下,荧光分子可以同时吸收两个波长较长的光子,经过短暂的所谓激发态寿命后,发射一个波长较短的光子;效果和用波长为长波长一半的光子激发荧光分子是一样的。双(多)光子成像的优点是具有更深的组织穿透深度,红外光可以在平面上探测到极限为1mm的组织区域;因为信号背景比高,所以具有更高的对比度;由于激发体积小,具有定点激发、光毒性小的特点;激发波长由紫外、可见光调整为红外激发,更加安全。美国双光子显微镜的成像视野
上一篇: 德国多通道膜片钳离子通道