支原体去除的实验步骤通常包括以下几个阶段:
1. 支原体检测:在进行去除之前,首先要确认细胞培养物是否受到支原体污染。这可以通过多种方法实现,如PCR法、LAMP法或支原体培养法。
2. 选择合适的去除试剂:一旦确认存在支原体污染,需要选择一种有效的去除试剂。
3. 去除试剂的添加:根据去除试剂的说明书,将试剂添加到受污染的细胞培养基中。通常,这涉及到将一定比例的去除试剂加入到细胞培养液中。
4. 孵育:添加去除试剂后,将细胞培养物放回培养箱中孵育。孵育时间和条件(如温度、CO2浓度)应根据试剂的推荐进行调整。
5. 监测去除效果:在孵育过程中,定期监测细胞的状态和去除效果。这可能包括观察细胞形态、生长速率的变化,以及通过显微镜检查是否有支原体存在的迹象。
6. 后续检测:去除过程完成后,再次使用支原体检测方法确认污染是否已被成功。
细胞被支原体污染了会有什么影响?苏州细胞支原体预防现货
在科研中,支原体检测是确保细胞培养纯净性的重要环节。以下是一些在科研中常见的支原体检测方法:
1. 支原体培养法:这是一种传统的检测方法,通过将细胞培养物接种到特定的培养基中,观察是否有支原体生长。这是直接的检测方法,但耗时较长,通常需要数周时间。
2. DNA染色法:使用荧光染料(如Hoechst或DAPI)染色细胞核,然后通过荧光显微镜观察。这种方法操作简便,可以快速得到结果,但特异性不高,可能会有假阳性。
3. 聚合酶链反应(PCR)法:这是一种分子生物学技术,通过设计特异性的引物,扩增支原体DNA,从而检测支原体的存在。PCR法具有高灵敏度和特异性,已成为日常细胞培养维护的可靠方法。
4. 核酸扩增技术(NAT):NAT技术通过扩增并检测特定的支原体基因组保守序列来进行支原体污染检测,具有快速、简便的特点。
苏州细胞支原体预防现货支原体检测有哪些方法?
LAMP法,即环介导等温扩增技术(Loop-mediated isothermal amplification),是一种在恒定温度下进行的核酸扩增方法。它由日本学者Notomi于2000年开发。LAMP法检测有以下特性:
快速高效:LAMP技术可以在1小时内把几拷贝的目的序列迅速扩增到10^9^~10^10^拷贝,扩增效率高。
简便性:LAMP技术不需要进行模板的预变性,减少了PCR技术升降温带来的影响以及对昂贵、精密实验仪器的要求,同时扩增效率高,可以在较短时间内完成检测。
LAMP法因其快速、高效、特异、灵敏和经济等优点,已经应用于病原菌、寄生虫、病毒、疾病和转基因产品检测等领域,并且还将广泛应用于临床诊断、环境监测、食源安全等领域,具有更为广阔的发展应用前景。
细胞培养中支原体难以彻底消灭的原因主要包括以下几点:
1. 无细胞壁结构:支原体是没有细胞壁的微生物,这使得许多作用于细胞壁的抗*素对支原体无效。
2. 微小体积:支原体体积小,能够穿过常规的除菌滤膜,例如0.20微米甚至0.10微米的滤膜。
3. 隐匿性:支原体污染初期很难被察觉,它们在普通光学显微镜下几乎不可见,因此细胞被支原体污染后,前期很难被发现。
4. 传播途径多样:支原体可以通过细胞培养物、细胞悬液、细胞培养用具等途径迅速传播。
5. 污染源 :支原体污染源包括细胞间的交叉污染、操作人员的口腔、皮肤,以及细胞培养用的组分如血清、培养液等。
6. 环境因素:实验室环境、试验台、超净台、培养箱等可能被支原体污染,引起细胞的污染。
7. 抗*素耐药性:支原体可能对某些抗*素产生耐药性,使得治*效果变差。
8. 检测和清理方法的局限性:一些传统的支原体检测和清理方法可能不够灵敏或有效,导致难以彻底清理支原体
支原体检测实验的设计?
支原体是一类细菌,由于缺乏细胞壁,具有灵活的膜结构。这使得支原体的形态多变,很难在高倍显微镜下识别。并且能够抵抗压力、温度、渗透压和脱水,对许多针对细胞壁合成的常见抗*素具有抗性。它们的体积非常小,直径通常在0.15~0.3μm,因此能够轻易地穿过过滤系统。支原体能在哺乳动物细胞培养中可以高浓度生长,而不引起明显的混浊或其他可见的污染迹象。
支原体通过特殊的前端细胞器与宿主细胞结合。支原体前端细胞器富含粘附素,可以附着在真核细胞上并穿透宿主细胞。支原体缺乏刚性细胞壁,可能有助于其与宿主细胞膜融合,并交换其膜和细胞质成分。支原体的对细胞的毒性包括支原体侵袭性、分泌的致病酶和一些膜成分等都能够有效地侵犯宿主。
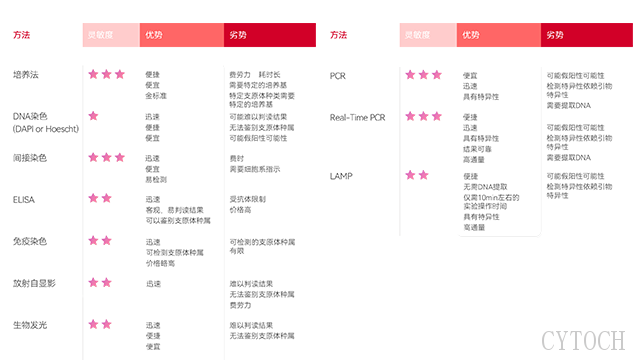
支原体检测PCR法和LAMP方法的优劣势比较。温州细胞培养支原体去除现货
对于同一个样品,为什么一步法恒温试剂盒检测结果为阳性,而PCR检测为阴性呢?苏州细胞支原体预防现货
qPCR法,即定量聚合酶链式反应(Quantitative Polymerase Chain Reaction)法,是一种高度灵敏和特异的分子生物学技术,用于检测和定量DNA序列。在支原体检测中,qPCR法的原理主要包括以下几个步骤:
1. DNA提取:首先从待测样本中提取DNA,这可能包括细胞培养上清液或组织样本中的支原体DNA。
2. 设计特异性引物:针对支原体的保守DNA序列,如16S rRNA基因,设计特异性的DNA引物。
3. 荧光标记探针:使用荧光标记的探针,该探针与目标DNA序列互补,能够在PCR扩增过程中与扩增的DNA结合。
4. Ct值确定:Ct值(阈值循环数)是指在PCR反应中,荧光信号强度超过预定阈值的循环次数。Ct值越低,表示样本中支原体DNA的量越多。
5. 定量分析:通过标准曲线法或相对定量法,将Ct值转换为支原体DNA的定量结果。
qPCR法的优势在于其高灵敏度和特异性,能够检测到非常低水平的支原体污染,并且可以在短时间内提供结果,这对于需要快速检测的生物制品生产和细胞培养质量控制非常重要
苏州细胞支原体预防现货