惠州病理切片免疫组化实验流程
在免疫组化实验中可通过以下方式防止边缘效应:一是保证试剂均匀分布。在加样过程中,缓慢且均匀地滴加试剂,避免试剂在边缘和中心的分布不均,可以从边缘往中心逐步添加。二是优化孵育环境。确保孵育时的湿度均匀,可使用保湿盒,避免边缘区域因湿度降低而影响试剂作用,从而导致染色差异。三是注意样本处理。样本在固定、包埋等前期处理时,保证操作的一致性,避免样本边缘与中心部分出现物理或化学性质的差异。四是控制反应条件。如温度、反应时间等,使整个样本处于相同的反应条件下,减少因边缘散热快等因素造成的与中心区域的反应差异。免疫组化技术有助于鉴别不同的细胞类型。惠州病理切片免疫组化实验流程
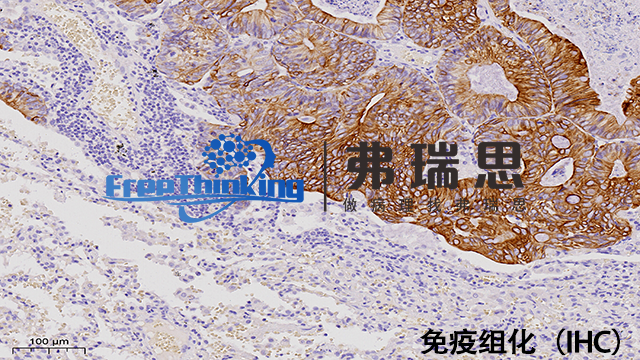
免疫组化SP三步法实验流程如下:一、切片准备1.石蜡切片脱蜡至水。一般使用二甲苯脱蜡,然后梯度酒精水化。2.进行抗原修复。可采用热修复或酶修复等方法,目的是暴露抗原决定簇。二、免疫反应1.阻断内源性过氧化物酶。使用3%过氧化氢溶液处理切片,减少非特异性染色。2.滴加一抗。一抗是针对目标抗原的特异性抗体,在湿盒中孵育,使一抗与抗原充分结合。3.滴加生物素标记的二抗。二抗能特异性识别一抗,孵育后清洗切片,去除未结合的二抗。4.滴加链霉亲和素-过氧化物酶复合物(SP)。SP能与二抗上的生物素结合,孵育后清洗。三、显色与复染**1.用DAB显色液显色,阳性部位会呈现棕黄色。显色时间根据具体情况调整。2.苏木精复染细胞核,使细胞核呈蓝色。3.脱水、透明、封片。经过梯度酒精脱水,二甲苯透明后,用中性树胶封片,便于观察。惠州病理切片免疫组化实验流程通过荧光或酶标记的二抗,免疫组化在显微镜下直观展示细胞内蛋白分布。
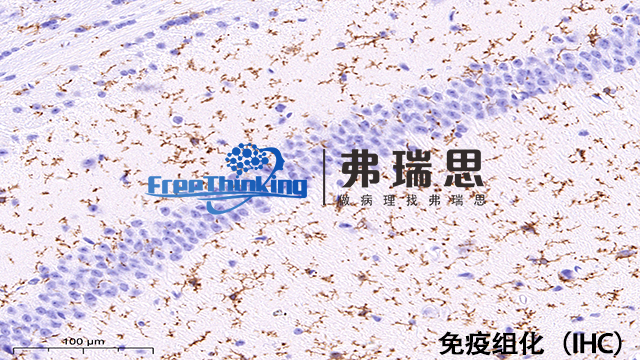
在荧光共定位研究的免疫组化实验中,选择荧光标记抗体有以下关键策略:一是合理选择荧光染料。要考虑不同荧光染料的激发和发射光谱,尽量选择光谱重叠少的染料进行多色标记,以清晰区分不同的目标抗原。二是优化抗体浓度。通过预实验来确定合适的荧光标记抗体浓度,既能保证足够的信号强度,又可避免非特异性结合产生的背景干扰。三是注意样本处理。确保样本的固定和通透处理方式适合荧光标记抗体的结合,保证抗原的完整性和可及性。四是做好对照实验。设置阳性对照和阴性对照,阳性对照用于验证抗体的有效性,阴性对照可排除非特异性结合等因素的干扰。
在免疫组化报告中,加号(+)和减号(-)表示特定抗原在组织中的表达情况。加号(+)表示该抗原在组织中有不同程度的表达。多个加号通常意味着表达水平较高,如(+++)表示高表达;较少的加号可能表示中等或低表达,如(+)或(++)。减号(-)则表示该抗原在组织中未检测到表达。这些符号有助于医生判断组织的生物学特性、疾病类型及进展情况等。例如,某些抗原的表达可能与特定疾病发生的发展相关,通过分析这些符号可以为疾病的诊断、预后评估及治疗方案的选择提供重要依据。对比常规染色,免疫组化提供更精确的组织病理学信息,助力疾病诊断。
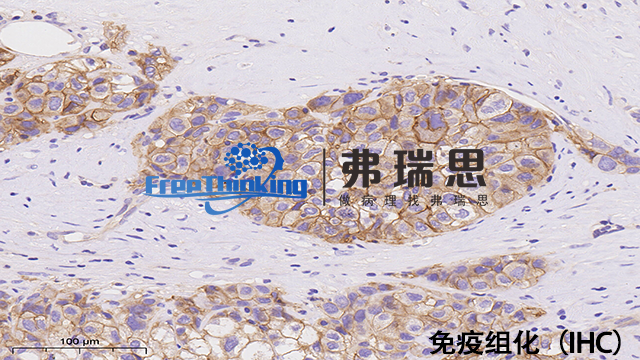
在免疫组化实验中,可从以下方面优化抗体孵育条件以确保结果准确可靠。其一,通过预实验确定合适的抗体浓度范围。设置不同浓度梯度进行尝试,观察染色效果,找到能清晰显示目标抗原且非特异性染色较少的浓度。其二,合理控制孵育时间。时间过短会使抗原抗体结合不充分致染色弱;时间过长则易出现非特异性结合。可通过试验确定适宜时长。其三,挑选适宜的温度。通常可选择室温或37℃孵育,温度不适宜可能影响结合效果。其四,保持孵育环境稳定。避免震动和温度变化,可借助恒温设备。之后,在孵育前后进行充分洗涤,去除未结合物质,减少非特异性染色,提升实验结果的准确性和可靠性。在进行免疫组化时,如何选择合适的一抗以确保实验准确性?惠州病理切片免疫组化实验流程
免疫组化能发现病变组织的细微特征。惠州病理切片免疫组化实验流程
从实验结果而言,免疫组化技术服务主要涉及以下方面:一、抗原定位1.确定目标抗原在组织或细胞中具体的位置,是在细胞核、细胞质还是细胞膜上。这有助于了解抗原的功能和作用机制,例如某些膜蛋白抗原定位在细胞膜上,与细胞的信号传导等功能相关。二、抗原表达水平1.通过染色的强度来定性或半定量地评估抗原的表达情况。强阳性表达可能暗示该抗原在特定生理或病理过程中发挥着重要作用,而弱阳性表达则可能表示其作用相对较小或者是表达受到抑制。2.比较不同样本之间抗原表达水平的差异,这种差异可能与样本的不同来源(如不同个体、不同发育阶段等)有关,为进一步研究提供基础。三、细胞类型特异性1.识别哪些细胞类型表达特定的抗原。不同的细胞类型可能对同一抗原的表达有所不同,这对于研究细胞的分化、功能特化等方面具有重要意义。惠州病理切片免疫组化实验流程
上一篇: 潮州多色免疫荧光病理图像实验流程
下一篇: 衢州切片病理图像实验流程