黑龙江药物安全性评价
药物安全性评价,2020年1月31日,美国卫生与公众服务部(HHS)发布了与COVID-19相关的突发公共卫生事件声明,随后FDA发布关于在COVID-19**期间开展药品临床试验的指南(FDAGuidanceonConductofClinicalTrialsofMedicalProductsduringtheCOVID-19PublicHealthEmergency)[30]。该指南旨在提供COVID-19**期间的一般注意事项,帮助申办方进行药物安全性评价,保持药物临床试验质量管理规范(GCP)合规性,并尽可能降低对试验完整性的风险。药物安全性评价中的统计学应用都有哪些?黑龙江药物安全性评价
疫苗新药临床前研究中药物安全性评价的难点在于疫苗本身并不直接发挥预防或***作用,而是通过诱导免疫系统产生抗体或活化T细胞发挥作用。在疫苗研发中需要考虑疫苗可能会产生的安全问题。(1)疫苗成分本身作为毒性物质对机体的直接损伤。(2)疫苗诱导免疫系统引起的与免疫相关的毒性。(3)污染物和残余杂质引起的毒性。疫苗制备的过程中的各个环节具有可能带入污染物或导致残余杂质的存在,控制此类毒性也是质量控制研究的主要目的。(4)若疫苗载体在体内变异,将威胁患者的生命。(5)其它未知的毒性。广东推荐的药物安全性评价公司药物安全性评价的方法有哪些?
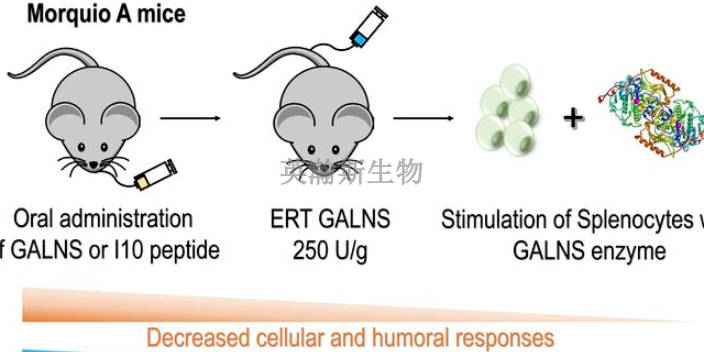
监管科学研究旨在开发新的工具、标准和方法进行受监管药物安全性评价。该学科是监管决策的基础,是用于人用药和兽药整个生命周期中评估其质量、安全性和有效性的科学。在医药产品开发和评价中,所用的科学技术必须进行改进,在毒理学的现代化、推动临床评价和个体化医疗的创新、创造新的方法以改进产品的生产工艺并提高产品质量、确保食品药品监管机构已经为创新技术的评估做好充分准备、借助信息科学利用好各种数据、推行以预防为主的食品安全体系、加快制定医疗对策以抵御各种威胁和进一步发展社会和行为科学以帮助消费者在选择产品时做出知情决策等8方面有重要作用。
药物安全性评价的重复给药毒性试验可以:预测受试物可能引起的临床不良反应,包括不良反应的性质、程度、量效和时效关系、以及可逆性等;判断受试物重复给药的毒性靶组织或靶组织;如果可能,确定未观察到临床不良反应的剂量水平(NoObservedAdverseEffectLevel,NOAEL);推测***次临床试验(FirstinHuman,FIH)的起始剂量,为后续临床试验提供安全剂量范围;为临床不良反应监测及防治提供参考。药物安全性评价就找南京英瀚斯生物。在药物的发现与开发中药物安全性评价的策略和安排是哪些?
首先,非临床安全性研究在支持创新药的临床研究时并不是在进入临床研究(I期)前完成所有相关研究,而是分阶段来分别支持I、II、III期临床研究,并为如何进行临床研究提供重要参考,具体体现在临床研究方案中的给药剂量(尤其是I期临床研究的起始剂量)、安全性检查/监测指标和检测时机的确定,危险性的预测和救治措施的实施等方面。其次,在临床研究过程中甚至上市后出现非预期重要的安全性问题且难以判断/预测其风险性等情况下,可能也需要再次进行有关的非临床安全性研究(包括机理研究),如此由临床研究信息来为非临床安全性研究提供的方向和目标,以期减少临床研究和/或临床应用的风险。其三,在临床研究完成后,对受试药的临床有效性和安全性已有一个基本结论,此时非临床安全性评价的某些结果(如致*性等)可能是确定受试药是否能批准上市(利弊权衡)的重要依据之一。药效学的研究有助于药物安全性评价。黑龙江药物安全性评价
药物安全性评价贯穿药物研发上市的全生命周期。黑龙江药物安全性评价
药物安全性评价,生产原材料方面,裸抗分子可参照同类品种(全新序列抗体或生物类似药)进行评价。小分子***、连接子作为ADC药物的关键原材料,应提供详细的起始物料、合成工艺、结构确证、质量控制等信息,应重点关注影响产品安全性的小分子化药杂质(可偶联、不可偶联)和有机溶剂残留。建议申请人对于含量较高的杂质(>0.1%)应进行结构鉴定或药物安全性评价,有机溶剂残留应符合按照ICHQ3A或2015版《中国药典》相关规定。生产工艺方面,应结合产品质量属性(平均载药量、聚体等)对化学偶联相关工序进行优化,通过设置工艺参数控制范围和建立中间体验收标准,保证工艺稳健性和产品质量一致性。偶联后纯化工艺一般采用凝胶过滤、切向流过滤或超滤技术等去除小分子杂质和有机溶剂。应结合工艺相关杂质的去除效果或残留量,对纯化工艺关键参数(过滤体积等)验证。黑龙江药物安全性评价
上一篇: 浙江值得信赖药物安全性评价价格
下一篇: 没有了