河南超声微泡siRNA
纳米微泡比超声微泡具有更好的被动瞄准能力,因为纳米微泡的尺寸小于1µm;因此,它们可以通过EPR效应渗透到血管壁并积聚在斑块内。超声微泡中使用的原料或外壳配方会影响表面电荷性质,同时颗粒大小决定了超声微泡在体内的分布。超声微泡的分布特性影响成像诊断的成功及其通过被动和主动靶向给药的有效性“被动靶向”一词指的是增强的per-merabilityretention(EPR)效应,该效应驱动无特异性靶向的裸超声微泡到达病变目标。然而,裸超声微泡通常在静脉注射后10分钟内被吞噬进入网状上皮系统(RES)与***中的内皮功能障碍相关,内膜微血管渗漏可以作为针对***斑块的药物递送的被动靶向途径。因此,纳米微泡比超声微泡具有更好的被动瞄准能力,因为纳米微泡的尺寸小于1µm;因此,它们可以通过EPR效应渗透到血管壁并积聚在斑块内然而,纳米微泡的缺点是无法获得高质量的超声成像因为小尺寸的气泡会降低声响应制备成像用纳米微泡的策略之一是调整和修改纳米微泡的壳体组成,以增加其回波性由于EPR效应与尺寸有关,研究人员在制造100-200nm左右的小尺寸纳米微泡方面存在困难目前的研究表明,与小于50nm和大于300nm的颗粒相比,100-200nm之间的颗粒尺寸在病变部位的蓄积更大。 心脏缺血区域的超声造影增强与对照组非缺血区域的信号有统计学差异。河南超声微泡siRNA
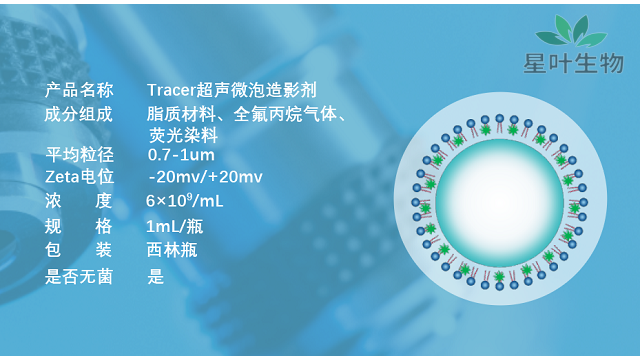
**组织中的生物学改变对纳米微泡的效率起着至关重要的作用。正常组织微血管内皮间隙致密,内皮细胞结构完整,而实体瘤组织新生血管内皮孔在380 ~ 780 nm之间,内皮细胞结构完整性较差。因此,与正常组织相比,一定大小的分子或颗粒更倾向于在**组织中聚集。这种现象被称为EPR (enhanced permeability and retention)效应,被认为是完成**组织被动靶向***的机制。在临床前试验中,与传统化疗相比,基于EPR的药物或基因递送靶向系统在***功效方面取得了显着进展。在过去的几年里,各种基于EPR效应的纳米材料已经被应用,其中纳米级纳米气泡的大小可以根据**血管中孔隙的大小而改变。鉴于不同类型**的内皮细胞中存在不同的间隙大小,因此必须根据**的类别建立合适尺寸的纳米材料。同样,纳米颗粒到达血液循环系统时,生物屏障所产生的阻碍也需要高度重视。因此,考虑到这些挑战,为了更好地利用纳米材料递送中的EPR效应,设计了各种处理方法。基于EPR的纳米颗粒靶向策略主要致力于调整药物或载体的大小和/或利用配体连接涉及EPR效应的分子。河南超声微泡siRNA这些配体组合的微泡靶向成功地在动脉血管区域积累,但在对照组小鼠中却没有,尽管有高剪切流量。

***个靶向微泡心脏成像研究是在急性缺血再灌注损伤模型中进行的,该模型在狗身上注射了涂有磷脂酰丝氨酸的白细胞靶向微泡,磷脂酰丝氨酸是颗粒吞噬摄取的标记物。这些微泡针对的是在血管中积累且尚未外渗的白细胞:在再灌注后1小时观察到**靶向的造影剂在梗死区积累。在心肌中观察到超声造影剂信号、中性粒细胞靶向放射性示踪剂的积累与髓过氧化物酶(炎症的酶标记物)之间的相关性。上述方法的对比机制是基于白细胞在缺血-再灌注损伤区与上调的细胞粘附分子(p-选择素、e-选择素、ICAM-1和VCAM-1)在血管内膜上的强烈结合现象。因此,不依赖白细胞作为微泡的二级捕获目标可能是更好的策略,而是设计真正的分子显像剂,直接结合内皮细胞上上调的p-选择素、e-选择素、ICAM-1或VCAM-1分子。这样的试剂已经可用,并在体外流动室设置以及模型体内系统中进行了测试。
超声微泡有效地产生反向散射超声,增强对比度,以便将目标部位(血管)与周围组织区分开来。它还可以比较大限度地减少噪声和背景信号。超声微泡的声学特性产生成像信号,由美国成像仪器检测。使用超声微泡进行诊断的频率范围约为2-18 MHz。共振频率与超声微泡的尺寸成反比,并受超声微泡表面配方特性的影响。超声微泡对波传播幅度的增加具有非线性响应,从而产生谐波频率分量,从而提高了美国成像的空间分辨率。超声微泡被用作造影剂,因为固体和液体颗粒无法提供超声微泡给出的后向散射信号。另一种实时无创成像技术是光声(PA)成像,它需要激光源照射、光敏剂和超声换能器来收集产生的声信号。PA成像是基于热弹性膨胀和造影剂存在下光子到超声转换的光能吸收。PA与超声波相结合,能够以高空间分辨率显示深部组织。Meng等人进行了一项简单的研究,利用超声波将mb转化为纳米颗粒,目的是在小鼠模型的PA成像过程中获得无背景的强信号。超声微泡的广泛应用使研究人员能够调整靶向效率和响应性,例如超声/光热/pH/光触发药物释放。靶向超声造影剂的一个潜在应用是用于基因。
除了靶向成像,超声微泡造影剂还可用于提供***有效载荷。血管通透性的同时释放和增强,如下面更详细讨论的,是超声微泡技术所独有的属性。设计用于干预的微泡配方的一个关键组成部分是将***剂装载到外壳上。气体**本质上是一个不隔离有机化合物的空隙,而脂质外壳太薄(~3nm),无法容纳足够的货物。一种增强负载的方法是将油引入溶解亲水或亲脂药物的脂质壳中。这种形成声活性脂球(AALs)的技术在体外输送化疗药物方面取得了成功。当存在阳离子脂质或变性蛋白质时,带负电的***物质,如DNA或RNA,可以静电耦合到外壳上。该技术已***用于基因转染实验。实验中观察到的脂质包被微泡的负载能力约为0.01 pg/um'。载药超声微泡造影剂的设计之一是使药物由于细胞内pH值的变化或外部光或声音的刺激而释放。河南超声微泡siRNA
纳米微泡的直径通常在150-500纳米之间,是药物分布的诱人场景并且与微泡相比已证明可以改善聚集和保留。河南超声微泡siRNA
载药超声微泡造影剂另一种选择是通过赋予超声微泡生物启发策略,其中天然细胞膜可以用作构建超声微泡的材料。天然细胞膜具有固有的合适特性,如生物相容性、免疫逃逸、自我识别和主动靶向特性。已有研究表明,血小板生物纳米微泡对血管损伤具有优越的靶向能力,可用于超声造影成像。另一种可用于靶向***的候选细胞是白细胞或巨噬细胞,因为它们具有可以特异性结合***斑块中VCAM-1受体的表面蛋白。为了增强细胞膜的降解,可以将超声微泡与光热剂结合,从而随着温度的升高,增加了现场降解的速度,从而提高了药物在病变部位的释放速度。河南超声微泡siRNA
上一篇: 福建靶向脂质体载药
下一篇: 天津脂质体载药六氟化硫